学术前沿

走近我们

母乳成分研究

婴幼儿营养健康

儿童营养健康

孕产妇营养健康

实用工具

如需《母乳研究白皮书》完整版,请点击链接浏览或下载:
https://share.weiyun.com/73eDZwud
母乳被认为是婴儿最佳的天然食物,世界卫生组织和联合国儿童基金会建议婴儿出生后前6个月实施纯母乳喂养,之后采用母乳喂养并添加适当辅食的喂养方式直至2岁或更长,以实现理想的生长发育和健康水平[1]。大量研究证明母乳中的营养成分可以促进婴幼儿消化、免疫和神经系统的发育;近期研究显示母乳还有诸多其他益处,例如,降低婴儿感染的风险以及远期肥胖和2型糖尿病的发生风险[2]。母乳是一种成分复杂且具有一定个体差异的众多营养物质的集合体,一般来说,成熟的母乳主要由大约87%水份、3.8%脂类、1.0%蛋白质和7%乳糖组成,此外还含有消化酶以及丰富的免疫细胞如巨噬细胞、干细胞等[3]。母乳的成分和含量会随着哺乳期的延长而不断变化,以适应婴儿的生长发育。分娩后5天内的乳汁为初乳,其中β胡萝卜素、蛋白质含量较多;产后5-14天的乳汁为过渡乳,其中蛋白质逐渐减少,而脂肪和碳水化合物的含量逐渐增多;产后14天以后的乳汁为成熟乳,各种营养成分含量比较稳定[4]。母乳中多种营养物质相互协同,共同促进婴幼儿的健康成长:通常,婴幼儿某种生理功能的实现需要多种营养成分的支持,而同一种营养成分也与多种生理功能密切相关。清楚认识母乳中的营养成分,可以更好地了解婴幼儿在生长发育中对各种营养成分的需求,对母乳代用品模拟母乳具有重要意义。因此本书现对母乳中的营养成分、生物活性功能以及在婴儿配方奶中的应用进行讨论。
1 母乳是一种复杂而精妙的营养体系
1.1 母乳营养成分与婴幼儿早期生理功能的复杂关系
母乳中含有多种结构复杂的蛋白质、脂类和碳水化合物等,母乳中丰富的营养成分共同发挥作用以支持婴幼儿早期的生长发育。母乳中的蛋白质是支持婴幼儿身体生长和脑发育的重要营养成分,具有提供营养、促进营养物质吸收、抗菌和增强免疫调节活性等功能[5]。母乳中的脂类是纯母乳喂养婴儿能量的重要来源之一,母乳脂类成分中含有构成大脑和视网膜细胞磷脂主要成分的花生四烯酸和DHA,因此母乳脂类对脑发育和视觉功能发育具有重要作用;脂类在婴幼儿的肠道经消化后还具有抗菌、抗病毒的作用;此外还发现母乳中的脂肪酸可降低早产儿肺支气管发育不良、坏死性小肠结肠炎及早产儿视网膜病变的风险[6]。碳水化合物不仅为婴儿提供能量,其中含有的低聚糖还可在肠道中被有益菌分解利用,维持肠道健康,增强婴儿抵抗外界感染的能力[7]。
1.2 母乳中营养成分相互协作支持生物功能的实现
母乳中含有的营养成分通过相互协同作用支持婴儿的生长发育[8]。Cheatham[9]等研究母乳中叶黄素、胆碱和DHA与婴儿的认知记忆能力的关系,结果显示母乳中高水平的胆碱协同高水平的DHA与婴儿更好的认知记忆能力相关,这种相关性在低水平胆碱和DHA中无法观察到。Isaacs[11]等研究探讨了母乳中抗菌物质之间的协同作用,通过抗菌脂质和抗菌肽建立一个体外系统并证实了抗菌脂质和抗菌肽互相具有协同灭菌的功能,抗菌脂质和抗菌肽通过各自不同的抗菌机制,协同产生的抗菌活性比单一抗菌物质的抗菌活性强,不仅降低了单纯疱疹病毒灭活所需的抗菌物质浓度,还缩短了单纯疱疹病毒灭活的时间。Moossavi[12]等总结了母乳中微生物和低聚糖与母乳喂养婴儿肠道微生物群变化的关系,他们可以通过调节婴儿肠道菌群的变化,进而影响婴儿的免疫系统,甚至降低哮喘的发生率。
母乳中各营养成分共同满足婴儿早期生长发育的需要,同时营养成分间也存在着多种相互协同作用。母乳代用品想通过添加某一种或几种关键营养素模拟母乳这种精妙而复杂的体系非常困难。因此,对母乳中的各营养成分进行全面系统的认识是十分必要的。
2 母乳蛋白质
蛋白质是婴儿身体及脑发育的关键营养成分,也是构成母乳的主要营养成分之一。目前发现母乳中的蛋白质种类已超过2500多种,这其中含有多种具有重要生物活性的蛋白质,可执行多种功能如提供营养、促进营养物质的吸收、抗菌和调节免疫活性等[12]。母乳蛋白质的含量随泌乳期延长而变化,初乳蛋白质的浓度最高,3至4个月泌乳期的母乳蛋白质浓度降低到1.4-1.6g/100mL,6个月泌乳期后蛋白质浓度减少至0.7-0.8g/100mL[13]。母乳中主要蛋白质是乳清蛋白和酪蛋白:乳清蛋白在胃中呈液态,易消化;酪蛋白在胃中会凝结成块。初乳的乳清蛋白和酪蛋白的比例为90:10,过渡乳的比例为65:35,之后基本维持在60:40左右[14]。
2.1 乳清蛋白
乳清蛋白占母乳蛋白质总量的60%左右,主要包括α-乳清蛋白(也被称为α-乳白蛋白)、乳铁蛋白和分泌型IgA。其中α-乳清蛋白在母乳的乳清蛋白中占比最高,约为乳清蛋白总量的36%。α-乳清蛋白易于消化吸收,其消化分解过程中产生的肽类物质在上消化道发挥重要的生物作用。另外,由于α-乳清蛋白可在小肠中被完全分解,所以母乳喂养的婴儿粪便中基本检测不到α-乳清蛋白[15]。α-乳清蛋白水解成肽类后具有增强铁和锌吸收的作用,Kelleher[16]等研究表明α-乳清蛋白可以促进婴儿时期的猴子对于锌离子的吸收。α-乳清蛋白还起到促进肠道中有益菌群增长的作用,Bruck[17]等通过双盲随机对照试验发现添加了α-乳清蛋白的配方奶喂养和母乳喂养的婴儿粪便中具有相近的双歧杆菌和乳酸杆菌的数量,因此,α-乳清蛋白发挥益生元样作用能促进肠道有益菌的生长,尤其是双歧杆菌的增殖;Dupont[18]等开展双盲试验对年龄为3周至3岁的婴幼儿喂食含有丰富的α-乳清蛋白的配方奶,与对照组比较发现喂食含有较高α-乳清蛋白配方奶的婴幼儿表现出更好的胃肠道耐受性。
乳铁蛋白是一种铁结合蛋白,其在母乳中以与铁结合的不饱和形式存在;乳铁蛋白参与铁的转运,具有抗感染及神经保护等生物功能。而另一类重要的乳清蛋白——免疫球蛋白,在泌乳早期含量丰富,其主要的形式为分泌型IgA,其次是分泌型IgG;这些物质不仅对婴儿提供免疫保护作用,同时也能帮助婴幼儿免疫系统的完善[15]。
2.2 酪蛋白
酪蛋白占母乳蛋白质总量的40%左右,主要包括β-酪蛋白和κ-酪蛋白等。其中,β-酪蛋白含量最高,占母乳中酪蛋白总量的68%。β-酪蛋白是婴儿重要的氨基酸来源,在婴儿肠道内被分解成相对分子质量更小的生物活性肽,持续发挥多种生物活性作用。β-酪蛋白具有促进钙离子、铁离子的吸收和免疫调节的功能。β-酪蛋白中的苏氨酸或丝氨酸残基会被磷酸化,这些磷酸化的氨基酸残基相互靠近时会与钙离子螯合,保持钙的可溶性,并促进钙离子在小肠的吸收[15]。Kibangou19]等研究发现β-酪蛋白水解后产生活性多肽——β-酪蛋白磷酸肽,可以抑制肠道磷酸酶的活性从而促进铁离子吸收。Chatterton[20]等详细阐述了母乳蛋白质在新生儿肠道中的抗炎机制,其中β-酪蛋白水解后可以产生具有肠道保护作用的多肽以维持肠道的屏障功能。而κ-酪蛋白作为一类高度糖基化的蛋白质,其糖链聚合形成一种复合低聚糖,这种复合低聚糖结构类似于暴露在粘膜表面的聚糖,常常作为病原体结合的位点,从而阻止病原体的感染[15]。
2.3 其他蛋白质
母乳中除了含有大量乳清蛋白和酪蛋白,还含有1%-4%的乳脂球膜蛋白,目前研究发现的乳脂球膜蛋白质主要包括黏液蛋白、乳凝集素和嗜乳脂蛋白[21]。另外,母乳中还含有其他一些具有生物学功能的蛋白质,包括溶菌酶、骨桥蛋白 、α1-抗胰蛋白等。溶菌酶可以水解细菌细胞膜上的粘多糖,从而通过破坏细菌细胞膜而杀死细菌,起到抗菌的作用[23]。骨桥蛋白是一种被高度糖基化和磷酸化的蛋白,能与整合蛋白受体相结合,骨桥蛋白参与细胞介导的免疫反应和抗炎反应,由于母乳中的骨桥蛋白在新生儿的胃液中被分解,因此骨桥蛋白主要在新生儿的上消化道发挥生物活性[23]。此外,母乳中含有大量的α1-抗胰蛋白,它能抑制胰蛋白酶的活性,使一些特殊的母乳蛋白在小肠中保持活性结构并持续发挥生物活性[24]。
2.4 伊利与中国母乳蛋白质研究
伊利对中国母乳中蛋白质组分的研究已有近20年的历史。考虑到蛋白质在母乳中的重要地位和独特组成,自2003年启动中国母乳自主研究项目起,蛋白质一直是伊利关注的重点领域。
2008年是伊利基于中国母乳蛋白质研究取得巨大成果突破的一年——正式推出金领冠系列婴幼儿配方奶,并提出α+β蛋白组合专利申请。得益于伊利独有的专利技术,金领冠系列配方奶的α-乳清蛋白和β-酪蛋白含量大大提升,远高于未强化这两种蛋白质的配方。其中,α-乳清蛋白的含量提升为0.23g/100mL,与母乳α-乳清蛋白含量相吻合(0.18-0.308g/100mL);β-酪蛋白含量达到0.3g/100mL,更接近母乳β-酪蛋白含量0.26-0.40g/100mL这一参考范围。伊利这一突破性的技术尝试随即在2012年正式获得国家专利授权并荣获第十六届中国专利优秀奖(图1)。
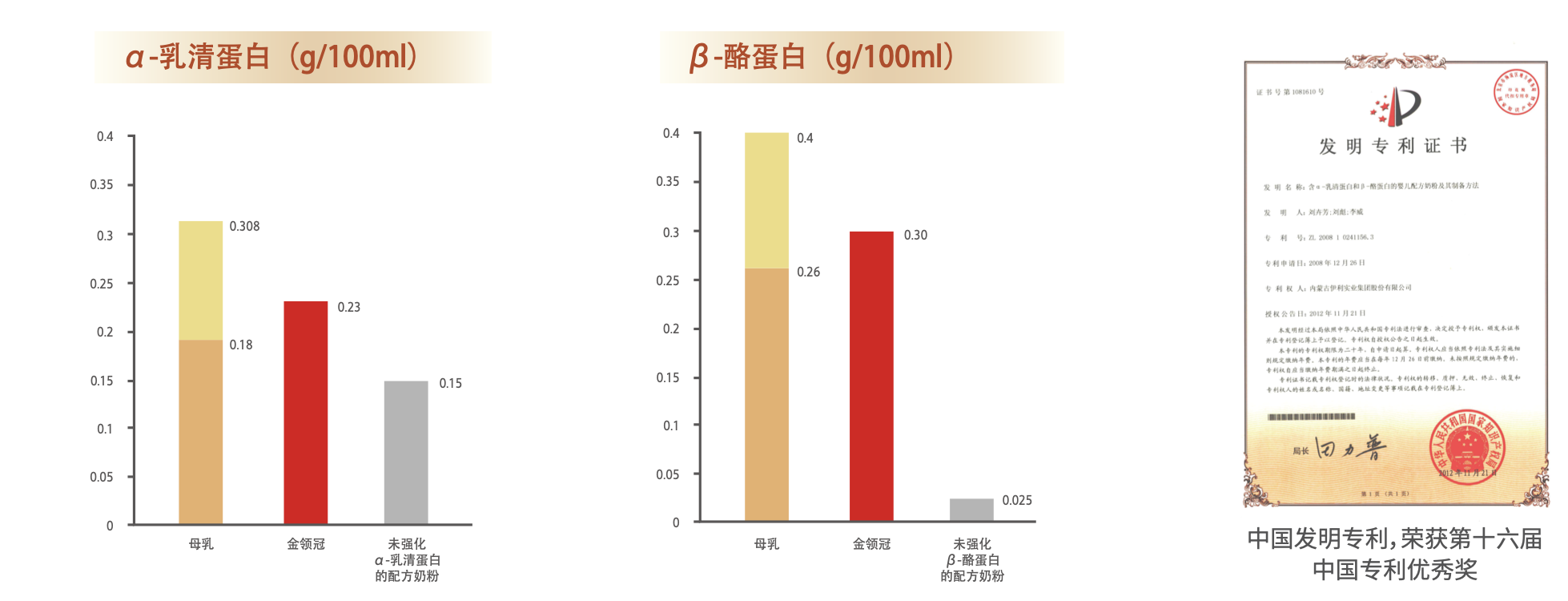
图1 金领冠中乳清蛋白和酪蛋白含量及发明专利
然而伊利对中国母乳蛋白质的探索并不满足于此。2015年起,伊利与荷兰瓦赫宁根大学展开深度合作,深入研究比较了中国与荷兰母乳蛋白组学的情况(图2)。运用蛋白组学的方法测定了中国母亲的乳清蛋白组在泌乳期的变化,并与荷兰母亲的乳清蛋白组进行了比较。研究发现,在20周泌乳期内,乳清蛋白质总量呈下降趋势,而且不同母亲的下降速度有所差异;初乳与成熟乳中乳清蛋白质的组成也不同,但是免疫活性蛋白、酶类和转运蛋白在所有的母乳样品中都是含量最丰富的[25]。另外,在中国和荷兰乳母的母乳乳清蛋白组中,含量最高的15种蛋白质之和均达到乳清蛋白总含量的95%。进一步比较两国母乳的乳清蛋白组成,发现有166种乳清蛋白是两国母乳中共有的,但其中22%的乳清蛋白质随着哺乳期的变化在中荷母乳中具有差异性,而这些差异主要来自于初乳含量的差异。研究还显示,在母乳中存在着与免疫活性蛋白高度相关的蛋白酶抑制剂,这些蛋白酶抑制剂可能与保护个别具备特定生物功能的蛋白质在消化系统中维持活性结构有关。这一最新研究成果在2019年被Nutrients杂志收录发表[26]。
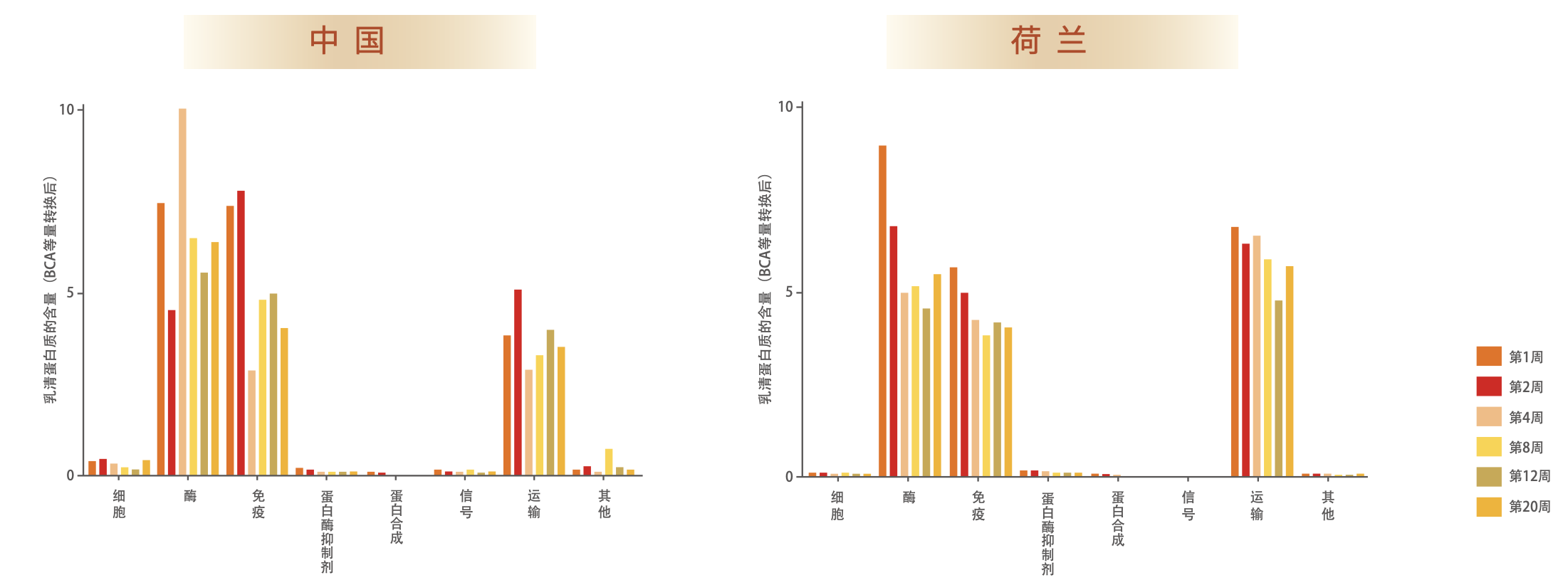
图2 中荷母乳蛋白组学乳清蛋白质组成的比较
3 母乳脂类
母乳中含有3%-5%的脂类,这些脂类提供了婴儿生长发育所需的膳食来源能量的一半左右[26]。大部分母乳脂类以脂肪球的形式存在,脂肪球的结构是由磷脂、胆固醇等组成的外膜包裹着层状排列的甘油三酯。母乳脂类中主要为甘油三酯(98%),其他的为类脂包括磷脂、糖脂、固醇和类固醇化合物等。母乳中脂类含量变化很大,随着泌乳期的延长,脂类含量会逐渐升高,不同地域不同个体间的脂类含量也存在差异[27]。Kumar[30]等通过分析欧洲、非洲和亚洲不同国家的母乳成分,发现母乳中的脂类含量在不同个体之间存在差异,即使在同一个国家不同区域的人群,其母乳中的脂类成分也存在差异。Giuffrida[29]等选择亚洲不同城市的540名女性的母乳进行分析检测脂肪含量,也得到地域不同母乳中脂类成分种类及含量不相同的结论。
3.1 脂肪酸
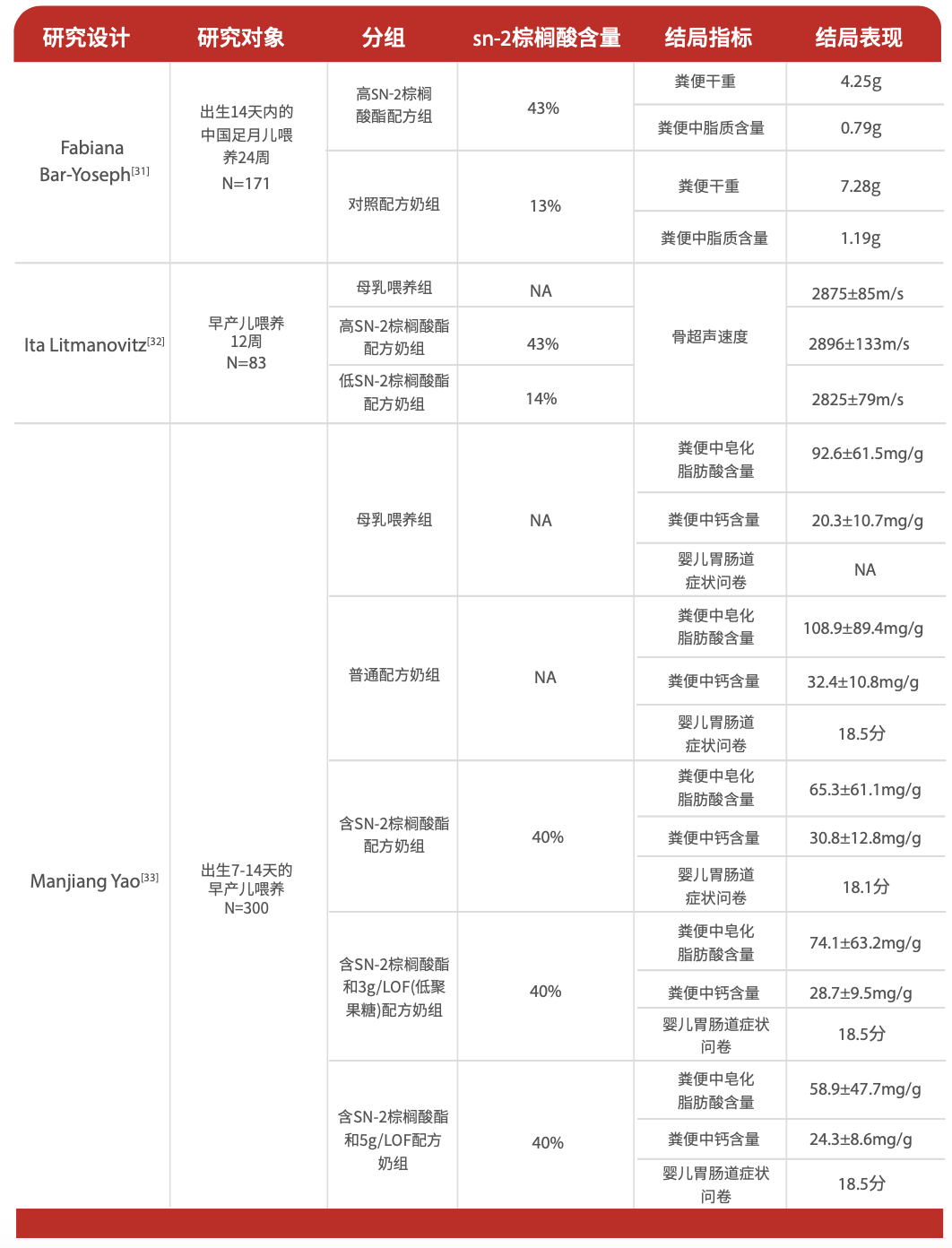
母乳脂类中含量最多的甘油三酯含有多种不同碳链长度的脂肪酸。棕榈酸是母乳中最重要的饱和脂肪酸,是婴儿早期最重要的营养来源之一。母乳中的棕榈酸大多结合甘油三酯骨架的SN-2位,具有独特的化学性质。Bar-Yoseph[30]等研究发现171位中国婴儿在食用富含SN-2棕榈酸的配方奶后,粪便的干重和脂肪含量均低于对照组,并且这一结论与已经发表的针对西方国家婴儿的研究结论一致,说明母乳中的SN-2棕榈酸甘油三酯结构有助于降低肠道游离棕榈酸含量,也相应调节了因游离棕榈酸与钙结合而影响的脂肪酸和钙的正常吸收。Litmanovitz[31]等发现喂养富含SN-2棕榈酸甘油三酯配方奶婴儿组的骨超声速度显著高于喂养低含量SN-2棕榈酸甘油三酯配方奶婴儿组,这主要是因为SN-2棕榈酸甘油三酯有助钙的吸收,进而帮助改善婴儿骨骼健康。Yao[32]等研究显示添加SN-2棕榈酸甘油三酯的配方奶有助于减少未被吸收的饱和脂肪酸,从而减少钙皂生成,改善婴儿粪便的性状,且母乳及添加SN-2棕榈酸甘油三酯的配方奶喂养儿的肠道菌群组成中有害菌更少(表1)。
表1 含SN-2棕榈酸配方奶与母乳以及普通配方奶对比研究汇总
3.2 类脂
3.2.1 磷脂
磷脂约占母乳脂类的0.5%-1%,虽然磷脂占总脂类比例小,但对婴儿生长发育有着非常重要的作用。磷脂不是一种单体成分,而是一种复杂的混合物,分为鞘磷脂(SM)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)和磷脂酰丝氨酸(PS)。磷脂的成分随泌乳时间和乳母的营养状况等因素而变化[33]。Verardo[34]等综述中表明初乳和过渡乳中的磷脂酰胆碱含量明显低于成熟乳,磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰乙醇胺含量随哺乳期的延长而增加; Holmes[35]等研究发现不同母亲之间母乳中胆碱含量差异较大,但是同一个母亲在不同时间的胆碱含量无明显变化。磷脂对婴儿脑发育和认知发育都有重要的作用,Liu[36]等研究通过在仔猪饲料中添加磷脂以便对其脑发育和相关学习能力进行评价,结果发现喂食添加磷脂饲料的仔猪的脑重量更大,因此推断出饮食中的磷脂含量可以影响新生仔猪大脑生长和结构,及其空间学习能力;Babenko[37]等通过喂食低能量食物使3月龄雄性老鼠的大脑中磷脂酰胆碱含量升高,且该雄性大鼠表现出条件反射活动的改善与磷脂酰胆碱含量升高显著相关。
3.2.2 乳脂球膜
母乳中的脂肪以脂肪球的形式存在,包裹脂肪球的膜结构称为乳脂球膜(MFGM)。乳脂球膜的厚度为10-20nm,主要成分为磷脂和特异性蛋白质,二者占乳脂球膜干重的90%以上。乳脂球膜中的磷脂主要包括甘油磷脂和鞘磷脂等极性脂类;而乳脂球膜还含有超过200种蛋白质,如高度糖基化的特异性蛋白质等。此外,乳脂球膜中还含有胆固醇、酶和其他的微量成分[38](图3)。乳脂球膜对提高婴儿认知能力、改善代谢、降低感染性疾病发病率等均具有重要作用。Timby[39]等研究显示使用含乳脂球膜的配方奶喂养的婴儿,其认知功能评分显著优于普通配方奶,而与母乳组无显著差异。Timby[40]等另一项对婴儿的喂养研究发现,给予婴幼儿补充乳脂球膜、哺喂含乳脂球膜的婴儿配方奶喂养可降低其中耳炎等感染性疾病以及腹泻的发生风险。Timby[41]等还通过随机双盲试验研究观察含乳脂球膜婴儿配方奶对婴儿生命早期营养的代谢程序化的影响,结果表明在干预期间添加乳脂球膜组的婴儿其总血浆胆固醇高于普通配方奶组,达到母乳喂养的水平。尽管低密度脂蛋白胆固醇与高密度脂蛋白胆固醇的比值与普通婴儿配方奶无显著差别,但添加乳脂球膜的配方奶使得婴儿的血脂组成更接近母乳喂养。
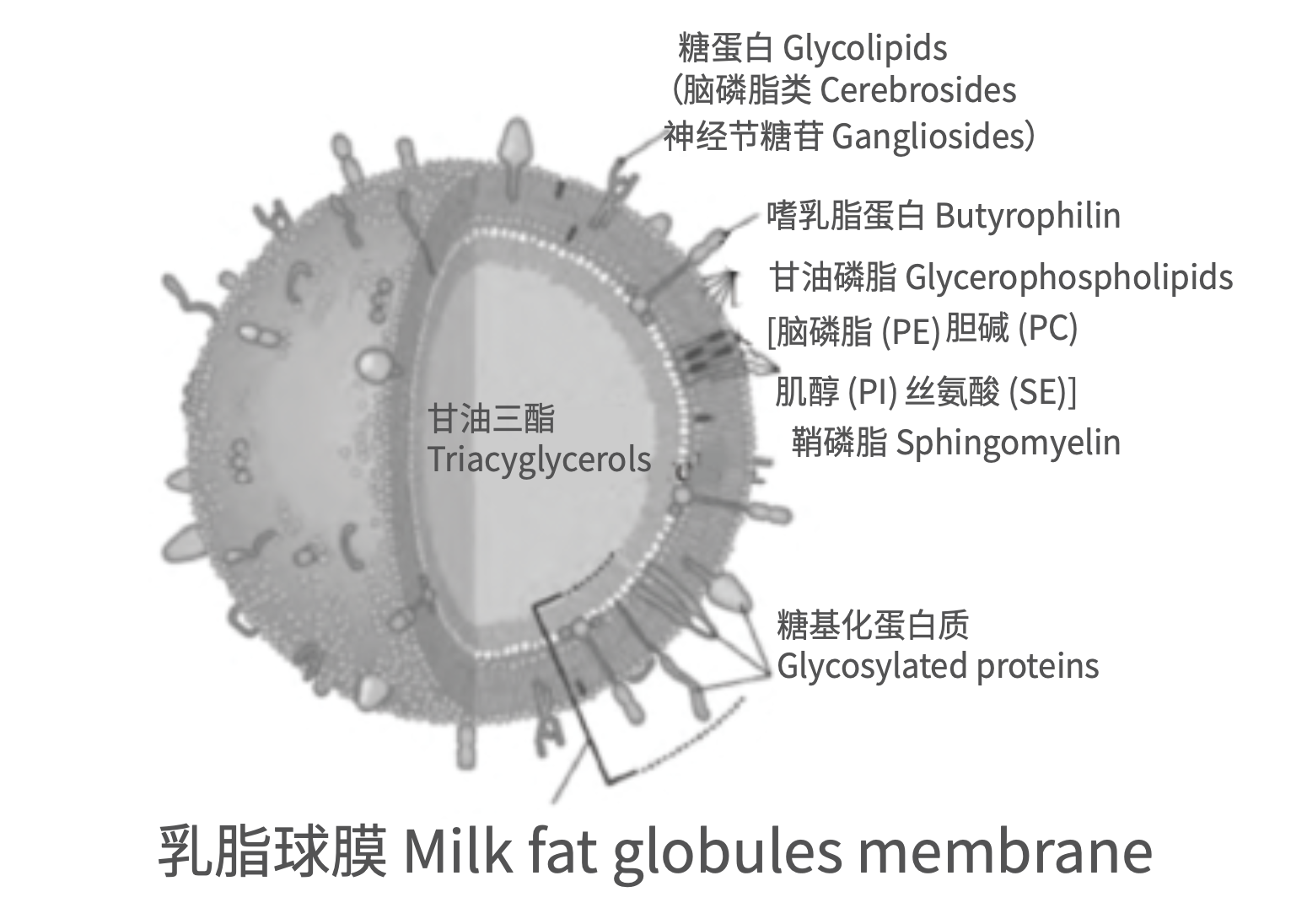
图3 乳脂肪球和乳脂球膜结构图
3.3 伊利与中国母乳脂类研究
伊利在母乳脂类方面的探索和尝试工作是开展较早的。早在2007年,伊利就已经着手改进配方奶中的脂肪酸组成和比例。2018年,伊利在国际专业期刊Food & Function上发表中国母乳SN-2位脂肪酸的相关研究成果,很好地补充了中国母乳SN-2位脂肪酸相关的研究数据不足[42]。研究人员采集了内蒙古、江苏、广西等地区的女性在产后不同阶段的母乳,并对超过60种脂肪酸在甘油骨架上的分布情况进行了分析,测得了基于中国母乳的SN-2棕榈酸含量数据。另外,该研究还发现了不同脂肪酸含量与膳食习惯、地域间的关系。例如,中国母乳中单不饱和脂肪酸(MUFA)的水平与乳制品、蛋类、鱼虾的摄入呈负相关,而饱和脂肪酸(SFA)的水平则与肉类摄入相关。这些结论都有助伊利更好地理解中国母乳,并据此不断推动和完善中国婴幼儿配方奶,使其更接近中国母乳成分,例如,伊利将配方奶中的SN-2棕榈酸的含量提升至了更接近母乳的65%,远高于目前市面上绝大多数的其他配方奶。
此外,伊利对母乳中的乳脂球膜组分也进行了积极地了解和尝试。2016年,伊利在Food & Function杂志发表乳脂球膜相关研究成果,主要针对母乳乳脂球膜中的蛋白质进行了鉴别测定。伊利在研究中共鉴定出411种MFGM蛋白,发现初乳中乳脂球膜蛋白以组蛋白H3和乳铁蛋白为主,并检测到多种酪蛋白(αs1-酪蛋白, αs2-酪蛋白, β-酪蛋白, κ-酪蛋白)。另外,相比成熟乳,初乳中多种蛋白的含量更高,在新生儿免疫系统发育中起着重要作用[43]。这些已发表的母乳脂类数据以及诸多正在进行中的研究为伊利推动中国母乳研究事业以及升级配方奶提供了重要的参考和依据。
4 母乳碳水化合物及其衍生物
母乳中含有6.5%-7.5%的碳水化合物,目前大多数研究显示母乳中的碳水化合物含量在泌乳期各阶段变化不大,在成熟乳中含量基本稳定,其中最主要的成分是乳糖,含量约为70g/L,与人脑的高能量需求相适应[44]。
4.1 碳水化合物
母乳中的碳水化合物以乳糖为主,其次含有游离的葡萄糖、半乳糖等。Chang[45]等研究结果显示,母乳中的乳糖含量在产后1-2周、2-4周、1-2月、2-3月、3-4月、4-5月、5-6月、6-7月和7-8月等泌乳不同阶段间的差异无统计学意义,提示在不同泌乳期乳糖含量稳定。研究还发现,母乳中的乳糖含量与乳母的体质量指数(BMI)呈负相关[45]。刘继超[46]等按婴儿性别分组观察母乳乳糖在不同泌乳时点的含量变化。研究结果发现,除了母乳中乳糖含量不随泌乳时间延长而改变外,婴儿性别间母乳乳糖含量无显著性差异。
Gidrewicz[47]等系统综述了26篇早产儿母乳和30篇足月婴儿母乳成分的研究,结果显示无论早产儿还是足月儿,初乳的脂肪和乳糖含量均低于成熟乳,母乳成分在产后2周到12周均比较稳定。Prentice[48]等检测了614份包括纯母乳喂养和混合喂养模式的母乳样本,检测母乳中营养成分并对比,结果发现纯母乳喂养组母乳的脂肪含量更高,但是乳糖含量、蛋白质含量较低。这里需要说明的是,这些观察数据也存在很大的局限性,特别是母乳采样方法和储存母乳样本在后续测定中重新混匀的困难。研究显示,同一次哺乳(泌乳)过程中,后奶中脂肪含量显著高于前奶。
4.2 碳水化合物的衍生物
4.2.1 低聚糖
母乳低聚糖是母乳中碳水化合物的重要组成部分。检测数据显示,产后4天的母乳乳汁中低聚糖平均含量为20.9g/L,成熟乳中平均含量为12.9g/L[49]。但因不同研究的检测方法差异,实际检测含量有一定差距且存在较大的个体差异。母乳低聚糖在婴儿体内起到益生元样的作用(如促进益生菌的生长),是母乳喂养婴儿早期获得良好肠道微生态(以双歧杆菌为主的肠道菌群)以及免疫功能平衡发展的主要因素[50]。母乳低聚糖在预防新生儿腹泻和呼吸道感染方面发挥着重要作用。此外,母乳低聚糖作为免疫调节剂,可以改变肠道环境、调节肠上皮细胞反应、诱导细胞分化与凋亡,以及调节机体免疫应答。
4.2.2 唾液酸
唾液酸是一类含9个碳原子的羧基化单糖酰化衍生物的总称,最初从下颌下腺分泌的粘蛋白中分离出来,并由此命名为唾液酸。唾液酸在婴儿体内通常以糖复合物的形式存在,参与神经细胞增殖、神经元分化和突触形成等过程,尤其是在大脑灰质中含量很高[51]。Wang[52]等发现,母乳喂养儿的前额叶大脑皮层中唾液酸含量显著高于喂养配方奶喂养儿,这表明唾液酸对脑发育的重要性。在Gurnida[53]等进行的双盲随机对照试验中,添加唾液酸的婴儿配方奶喂养的婴儿其血清神经节苷脂水平显著增高,且在手和眼的协调性测试中表现更优异。Liu[54]等检测了150例产后3-4天、42天正常母乳中的唾液酸水平,同时检测婴儿的精神和运动发育状况,用中国儿童发展中心制定的0~3岁婴幼儿智能发育量表(CDCC)进行评价,结果显示母乳唾液酸水平和婴儿精神、运动发育指数(MDI和PDI)成正比。
4.3 伊利与中国母乳低聚糖相关研究
母乳低聚糖是近年来母乳营养成分研究的热点领域,因此,从2015年开始,伊利与荷兰瓦赫宁根大学的合作也包括了对中国与荷兰母乳中人乳低聚糖的相关研究。在这些研究中,研究人员检测了中荷母乳的母乳低聚糖含量及随泌乳期变化情况,首次对比了中外(荷兰)母乳低聚糖含量。研究发现,中国母乳中低聚糖的含量为8-23g/L,且在亚组分构成上与荷兰母乳存在一定的区别(图4和图5)。这是伊利继蛋白组学研究中发现中外母乳不同之外,再一次确认中外母乳在人乳低聚糖组成上的差异。这也证明了伊利积极研究中国母乳组成的决策和行动具有深远意义[55]。
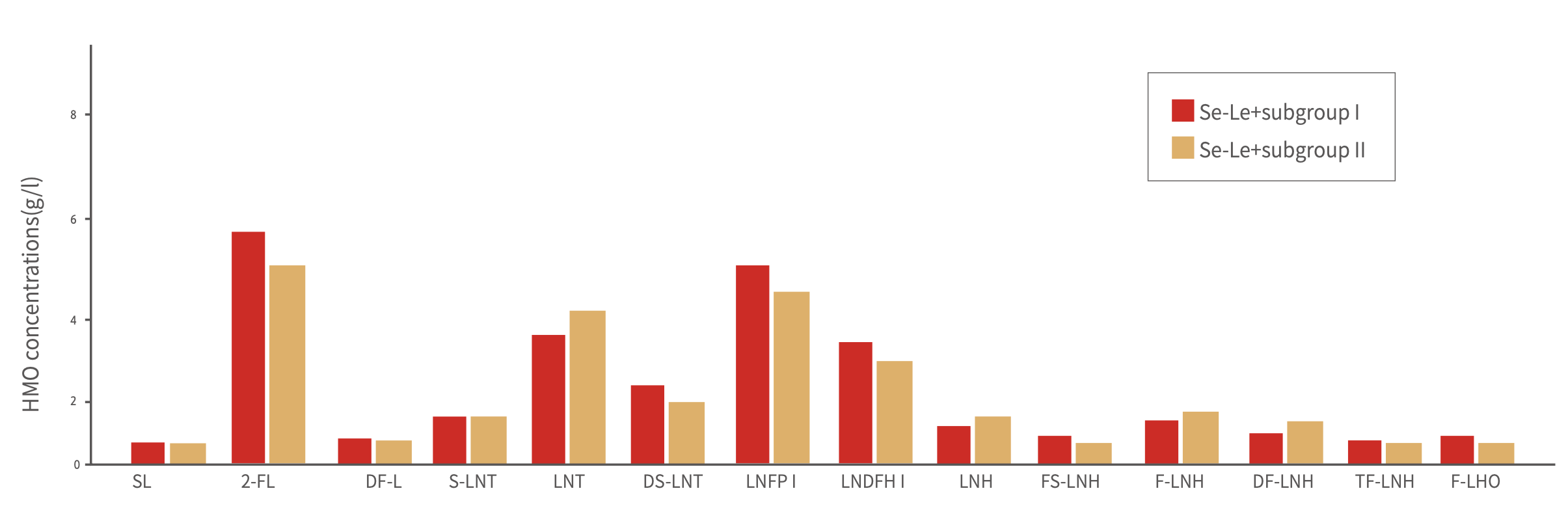
图4 中国母乳中各种人乳低聚糖组分及其含量
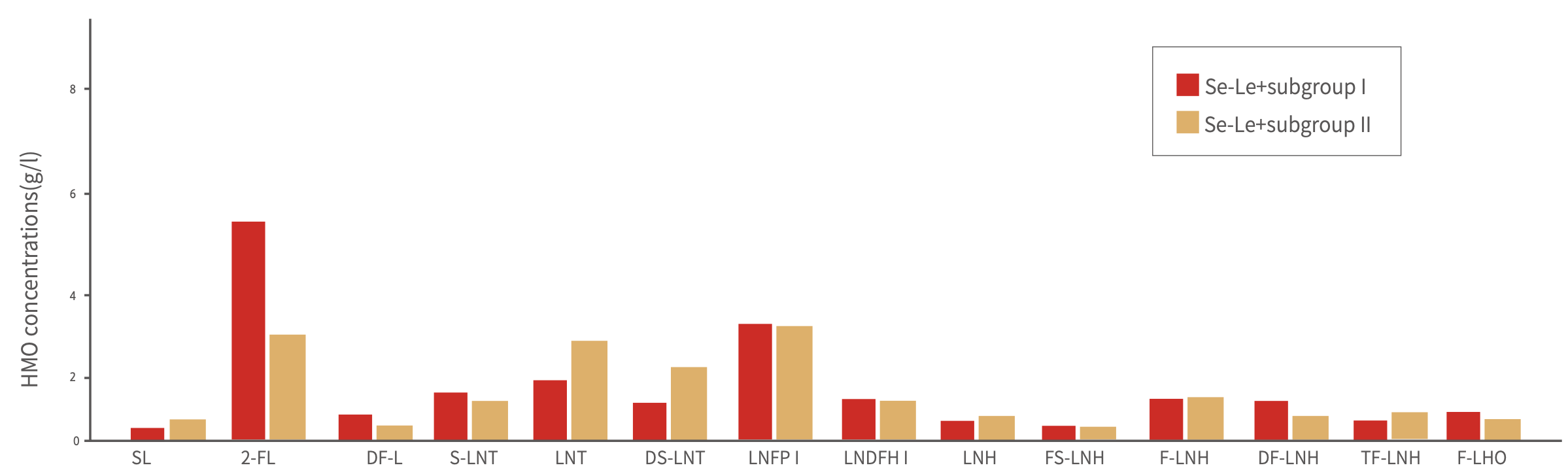
图5 荷兰母乳中各种人乳低聚糖组分及其含量
Se+Le+,即Lewis阳性分泌型;SL,唾液酸乳糖;2-FL,2-岩藻糖半乳糖;DFL,双岩藻糖半乳糖;S-LNT,唾液酸内酯-N-四糖;LNT,乳酸-N-四糖;DS-LNT,二唾液酸内酯-N-四糖;LNFP,乳酸-N-岩藻糖-牛乳糖;LNDFH,乳酸-N-二岩藻糖基己糖;LNH,乳酸-N-己糖;FS-LNT,岩藻糖基-唾液酸内酯-N-四糖;F-LNH,岩藻糖基内酯-N-己糖;DF-LNH,二岩藻糖基内酯-N-己糖;FUT,岩藻糖基转移酶;TF-LNH,三岩藻糖基乳糖-N-己糖;F-LNO,岩藻糖基乳糖-N-八糖;其中,2-FL及LnNT经欧洲食品安全局(EFSA)和美国FDA批准用于食品添加剂。
5 母乳核苷酸
核苷酸是一种存在于母乳中含量丰富并对婴儿发育有重要作用的营养物质。人乳中含有游离核苷酸和核苷,核苷酸的体内合成物、寡聚和多聚核糖核酸也可通过消化和代谢作为母乳中核苷和核苷酸的潜在来源[61]。母乳中的核苷总量在不同泌乳期的含量不同,其中的游离核苷酸以胞嘧啶核苷酸含量最高,腺嘌呤核苷酸、尿嘧啶核苷酸含量稍少。次黄嘌呤核苷酸的含量在不同研究中报道差异较大[56]。
核苷酸在婴儿的生长发育中起到促进作用,Singhal[57]等研究发现添加了核苷酸配方粉喂养的婴儿,其头围与未添加核苷酸配方粉喂养的婴儿相比增长更多,且差异具有统计学的显著性。核苷酸还能改善肠道菌群,Singhal[58]等在另一研究中发现添加核苷酸的配方奶喂养组与普通配方奶喂养组婴儿相比,粪便中的普氏菌和双歧杆菌的比例更接近母乳喂养儿的比例。Gil[58]等研究发现婴儿在喂食添加核苷酸配方奶四周后,粪便中双歧杆菌的含量比喂养未添加核苷酸的配方奶婴儿的高。以上研究结果均提示,核苷酸有助于改善婴儿肠道微生物菌群,增加双歧杆菌的数量。核苷酸还具有调节免疫的作用,Kit[60]等研究发现核苷酸配方奶喂养儿与未添加核苷酸的普通婴配奶喂养的对照组婴儿相比,免疫球蛋白IgA含量显著升高,Gutierrez-Castrellon[61]等通过循证医学综合分析后的结果表明,哺喂添加了核苷酸配方奶的婴儿在接种了白喉类毒素后会产生较好的抗体反应,同时减少腹泻的发生并且降低上呼吸道感染的风险。
从现有的母乳核苷和核苷酸相关研究发现,中国的母乳核苷酸与其他国家的母乳核苷酸在组成和含量上存在差异。Tressler[62]等分析研究中国香港、菲律宾和新加坡的母乳样本发现,香港和新加坡母乳中初乳样本的总潜在可利用核苷含量(TPAN)低于菲律宾母乳样本;香港的过渡乳样本的TPAN含量最高,但成熟乳样本的TPAN含量最低。Leach[63]等检测分析来自欧洲四个不同国家的母乳样本,其胞嘧啶核苷、尿嘧啶核苷、鸟嘌呤核苷和腺嘌呤核苷的平均浓度分别为146μmol/L、67μmol/L、91μmol/L、97μmol/L,这显著不同于Liao[64]等发表的关于中国台湾地区人群母乳中核苷含量的研究结果,Liao[64]等通过对24个台湾地区女性的母乳样本进行分析得出胞嘧啶核苷、尿嘧啶核苷、鸟嘌呤核苷和腺嘌呤核苷的平均浓度分别为9.25μmol/L、6.33μmol/L、0.36μmol/L、0.18μmol/L。
5.1 伊利与中国母乳核苷酸研究
核酸类物质的研究在伊利中国母乳营养成分研究计划中具有十分重要的地位。市售婴幼儿配方奶大多添加5种核苷酸,但并未对各种核苷酸的含量分布进行论证和匹配。伊利在对中国母乳核酸类物质进行检测分析后,获得了中国母乳中潜在可被利用的核苷酸总量值及各种核苷酸比例分布的数据,同时对比了中国母乳与市售婴儿配方奶中核苷酸比例分布情况,发现两者比例存在差异。在深入研究中国母乳中不同核苷酸含量的基础上,伊利开发了专有核苷酸专有比例及含量的婴儿配方奶,并通过动物试验对比了不同配比核苷酸配方粉对免疫功能的影响,发现基于专有核苷酸配比的产品在增强免疫力方面表现优于其他配比并且获得了国家的3项专利授权(图6)。

图6 伊利核苷酸研究成果获得三项国家专利
6 母乳微生物
母乳并非无菌液体,据估计,每天喂养800毫升母乳婴儿可获得107-108个细菌。通过生命早期细菌和宿主相互作用的研究,提示母乳中的细菌在婴儿肠道的早期定植为生长发育及成年后疾病预防起到重要作用,因此母乳被认为是婴儿肠道菌群的重要来源。母乳中最常见的细菌包括葡萄球菌、不动杆菌、链球菌、假单胞菌、乳球菌和乳酸菌等,母乳喂养可以减少宿主被致病性细菌定植[71]。Sharpe[66]等回顾性分析了两个母婴队列,分别有1334名婴儿哺喂未添加益生菌的巴氏消毒的母乳,457名婴儿喂养添加益生菌的巴氏消毒母乳,单因素分析结果显示喂养添加益生菌组的婴儿败血症的发病率和死亡率均显著低于未添加益生菌组,且坏死性小肠结肠炎的发病率也更低,与以往的观察性研究结果一致。
针对母乳中益生菌的功效研究大多采用已经分离到并研究确认其安全性和有益性的菌种进行研究,如乳双歧杆菌HN019,乳双歧杆菌BB12。这两只菌株并非来自母乳,其安全性非常高,经试验证明对人体无害。Mao[67]等采用随机对照试验将224名6-36月大的婴儿分成3组,在口服或静脉补液治疗基础上,分别给予去乳糖配方奶、添加108CFU/g BB12和5×107CFU/g嗜热链球菌、及添加109CFU/gBB12和5×108CFU/g嗜热链球菌的去乳糖配方奶,结果显示,尽管对腹泻病程无改变,但添加109CFU/g BB12组可见轮状病毒脱落减少,提示其在疾病传播的流行病学控制中的潜在意义。Rautava[68]等采取随机对照试验将72名出生第一年的婴儿分成两组,分别喂食添加BB12的配方奶和普通配方奶,研究发现食用添加BB12配方奶能显著促进婴儿免疫系统的成熟。Ahmed[69]等用HN019干预60岁老人4周,发现肠道中双歧杆菌、乳酸菌和肠球菌数量显著增加,而且5×109CFU/天(高剂量组), 1.0×109CFU/天(中剂量组)和6.5×107CFU/天(低剂量组)间差异无统计学意义,提示添加低剂量乳双歧杆菌HN019也能调节老年人肠道菌群。Ibarra[70]等没有发现HN019干预不能改善功能性便秘患者的结肠转运时间,但是如果限定在洗脱期报告排便频率≤3次/周的患者,乳双歧杆菌HN019干预则显著增加了排便频率,改善便秘症状和生活质量。
6.1 伊利与中国母乳微生物研究
早期肠道菌群的建立对婴幼儿的肠道功能以及免疫发育都具有深远的意义。因此,关于母乳微生物的研究一直都是学界和伊利研究的重点。由于母乳微生物组成的多样性与复杂性,配方奶中添加母乳微生物是十分困难的,不仅受到目前学术水平和认知的限制,同时也面临诸多来自法规和安全性方面的挑战。不过,受到母乳研究的启发,伊利也一直尝试在配方奶产品中采用安全性经过充分研究论证的BID复合益生菌(BID复合益生菌主要由BB12益生菌和HN019益生菌组成)以及低聚果糖(GOS)/低聚半乳糖(FOS)/异构化乳糖(LOS)多组分益生元来模拟母乳对婴幼儿肠道菌群的影响,以促进婴幼儿建立接近母乳的早期肠道菌群。科学研究表明,BID复合益生菌中的BB12可以降低腹泻发生率和婴儿胀气腹痛发生率[71];婴儿粪便中双歧杆菌数量显著高于普通奶粉喂养的婴儿,与母乳喂养婴儿水平相似[70]。HN019对消化道黏膜无刺激[72];作为肠道微生物活性的效应物,调节氨基酸的利用和氮循环,使肠道中有益菌数量增加[68];可以促进肠道收缩,改善便秘[73]。而LOS+GOS+FOS的益生元组合,可以促进有益菌的生长,并调节免疫能力[74]。这是一种通过多种不同成分共同促进,以实现肠道健康的案例,伊利在这过程中通过BB12和HN019复合益生菌结合多种益生元组合的方式模拟实现母乳中微生物对婴儿肠道的有益影响。
7 伊利开创系统模拟母乳∑时代
在过去的十八年间,伊利不断地在母乳研究领域探索,只为更贴合中国婴儿的营养需求。伊利始终认为,在无法母乳喂养或母乳不足时,作为配方奶研发和生产企业更应该以高标准去为婴儿提供替代的营养方案。配方奶的研发和生产绝不是根据厂商的技术特点和偏好来决定的,仅夸大某一营养元素的含量和功能,是在模拟母乳的道路上渐行渐远,与母乳复杂精妙的组成特点相违背。因此,伊利在过去十八年不断改进配方也正是为了能够尽可能还原每一种来自母乳的有益营养,真正做到系统模拟母乳。当然,系统模拟母乳的道路是艰难的。首先面临的问题就是如何正确理解母乳的组成?母乳组成十分复杂,学界至今对母乳的理解可能都只是真相的一小部分。中国在这方面的工作更是落后于国外,关于中国母乳组成含量的数据和资料十分稀少。因此,从2003年起伊利就下定决心,从头开始打造属于国人自己的母乳研究体系,从而真正了解中国母乳,并将其应用于为中国婴幼儿提供最好的早期营养。
另一方面,伊利一直是一家真正贯彻“科学指导配方”理念的乳企,尽其所能地将每一项中国母乳的研究成果应用于指导配方奶研发。配方奶中添加或改变营养成分是有着严格的法规标准的,尤其对于处在生长发育关键窗口期和脆弱期的婴幼儿来说,接近母乳的营养和安全是最为重要的。伊利秉持着“安全技术许可的条件下,尽可能全面地添加对于婴幼儿生长发育有益的母乳营养成分”,并在过去数年间对配方进行多次改变和扩展,真正将系统模拟母乳的理念灌注在产品之中。
– 从2003年开始,伊利启动中国母乳的自主研究,从基础的母乳采集着手。期间综合经济状况、饮食习惯、地理位置等因素,伊利选取中国12个典型省市自治区,共43个市/县的健康妈妈采集母乳样本,总计135,266毫升,获得了155项指标、1700余种成分的近千万母乳数据(图7)。
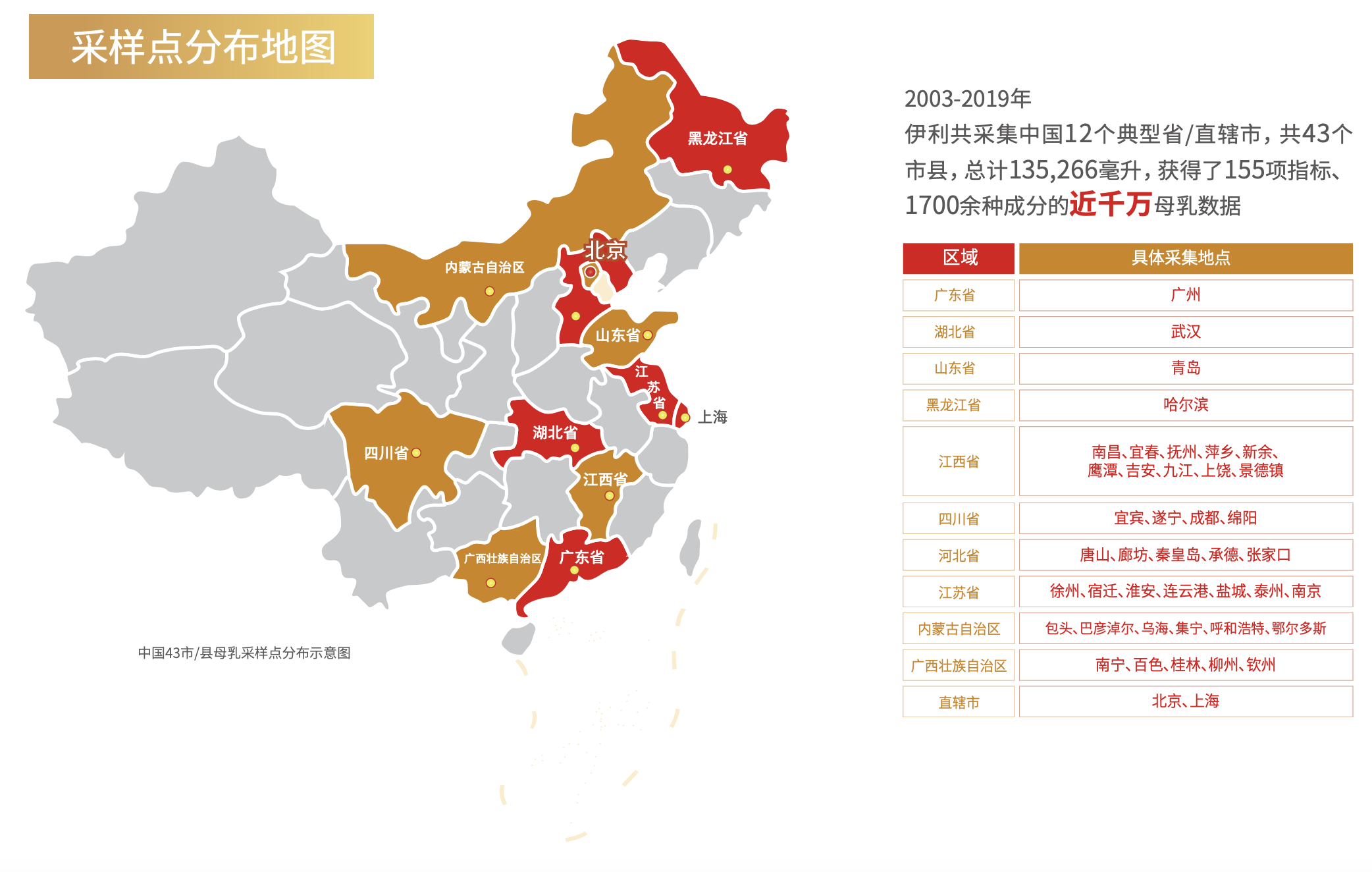
图7 中国43市/县母乳采集点分布示意图
– 2007年,建立首个中国母乳研究数据库。
– 2007年,升级调整脂肪酸比例。
– 2008年,推出专利技术实现的α-乳清蛋白+β-酪蛋白含量接近母乳水平的配方奶。
– 2009年,伊利母婴营养研究中心成立,并发布《中国母乳研究白皮书》。
– 2010年,建立中国乳企首个可供母乳研究使用的“母乳实物库”。
– 2011年,伊利对中国母乳中近100种营养和功能成分进行全面研究。
– 2011年,推出脂肪结构母乳化的配方奶。
– 2012年至今,伊利直接参与发表的母乳相关国内外学术研究已达到43篇,其中近70%的研究都被SCI、EI或中文核心期刊收录。
– 2014年,推出专利技术实现的核苷酸含量配比接近母乳水平的配方奶。
– 2015年,分别与荷兰瓦赫宁根大学、美国加州大学戴维斯分校(UC Davis)合作,在母乳低聚糖、蛋白组学等前沿领域展开深层次研究。
– 2016年,在国际期刊发表乳脂球膜相关研究成果。
– 2017年,在国际期刊发表乳清蛋白组学及母乳宏量营养素分析方法等多篇最新研究成果。
– 2017年,荣获中外母乳研究杰出贡献奖及关爱中国母婴健康社会责任奖。
– 2017年,推出国内首款应用异构化乳糖模拟母乳低聚糖效果的配方奶。
– 2018年,在国际专业期刊发表中国荷兰HMO及中国母乳OPO的研究成果。
– 2019年,发表中国荷兰母乳蛋白组学最新成果。
– 2019年,伊利作为中国乳企,首次参与ESPGHAN并举办首届母乳研究高峰论坛。
– 2019年,推出首款添加益生菌的原生有机配方奶。
– 2020年,推出国内首款同时强化了乳脂球膜和唾液酸的配方奶,获得PCT认证的核苷酸专利。
– 2020年,提出全面系统模拟母乳的“∑时代”。
可以看到,伊利在每一次的配方升级尝试中都在努力突破过往取得的成就,从脂肪酸、蛋白质、脂肪结构、核苷酸配比、低聚糖、再到益生菌等,伊利不会满足于某一营养成分所取得的成就,因为系统模拟母乳任重而道远。
对于母乳的系统模拟不能仅靠实验室获得的样本数据来评价,最理想的评价标准还是应当基于合适人群的临床研究结果。因此,伊利在2011年和2019年两次进行中国婴幼儿配方奶喂养效果评价研究,通过临床实践检验多年来对母乳了解和还原的成果。
2011年,伊利营养研究院和湖南疾控中心合作开展了伊利金领冠产品与母乳对照的临床试验。研究纳入了204名健康足月儿,分为伊利金领冠组,母乳喂养组和对照配方奶组,喂养90天,评价婴儿各项发育指标结果显示,伊利金领冠配方奶组在婴儿生长发育、行为发育、消化吸收和免疫力方面与母乳组没有显著差异(图8)。
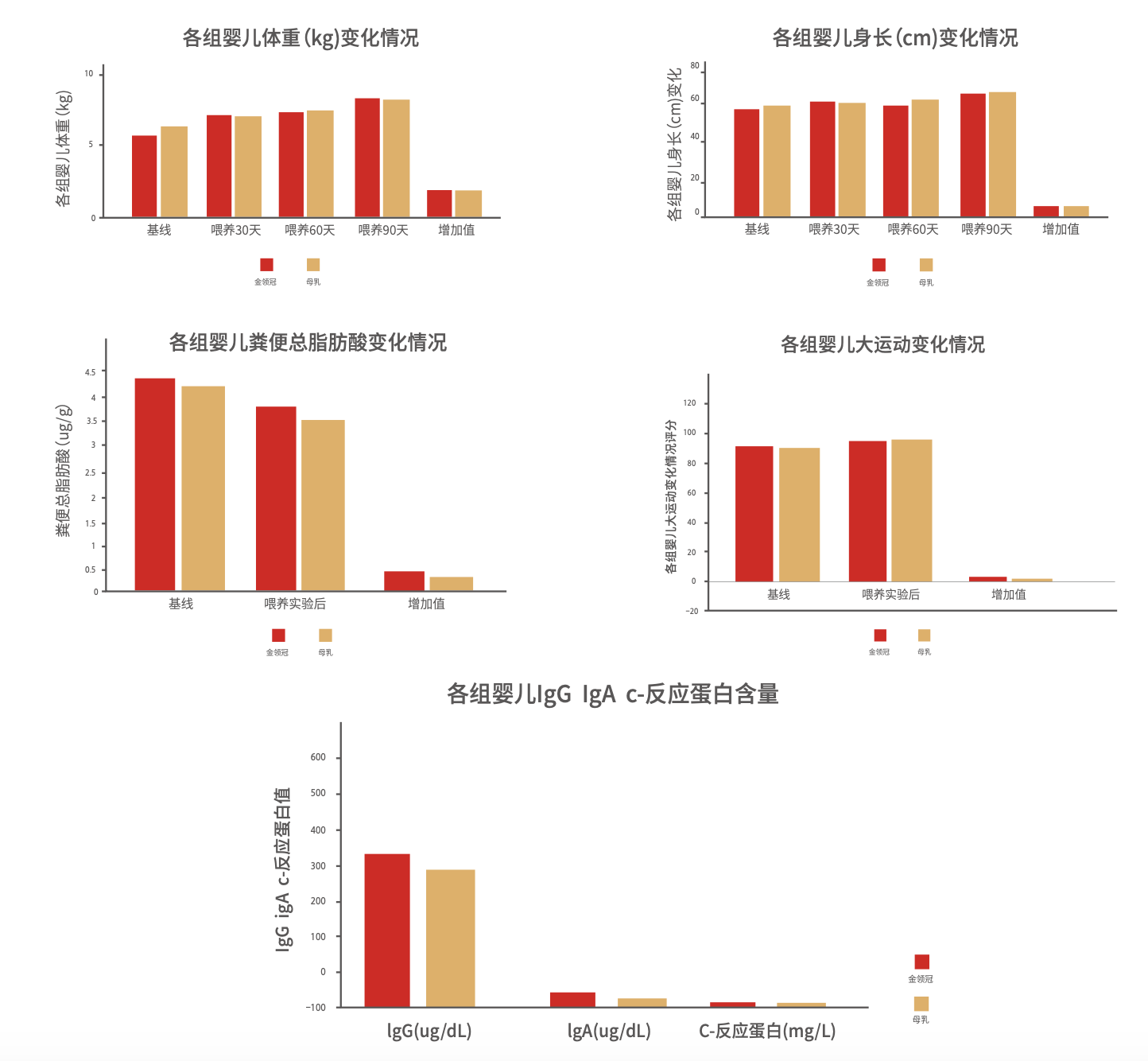
图8 母乳与金领冠喂养婴儿的生长发育对比
2019年,伊利营养研究院和北京大学合作的临床试验对比伊利金领冠配方奶与普通婴儿配方奶的喂养情况。研究纳入246名健康足月儿,分为母乳组、伊利珍护组和对照配方奶组,比较婴幼儿接受不同喂养方案的效果差异。结果显示,与对照组相比,喂养伊利金领冠配方奶的婴儿在生长发育、蛋白质吸收、钙吸收、神经认知发育方面都有更加良好的表现(图9)。
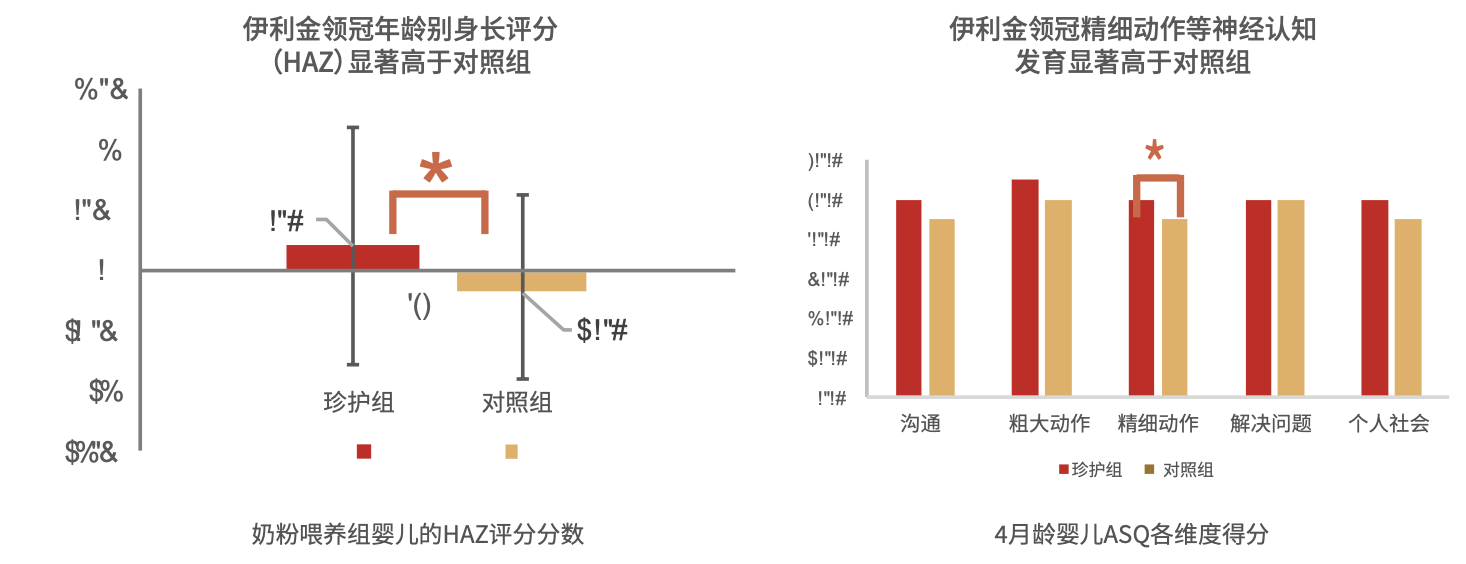
图9 金领冠与普通配方奶喂养婴儿的发育情况对比
注:HAZ评分,即儿童身长Z评分=(儿童测量数据—参考标准中位数)/参考标准的标准差,伊利珍护喂养组HAZ评分显著高于对照配方奶组;ASQ评分,即儿童发育筛查量表显示,伊利珍护喂养组ASQ评分精细动作子项目显著高于对照配方奶组。
对于乳企来说,依托权威机构利用自家配方开展针对本国人群的临床研究尚属不易,尤其是与其他品牌配方奶进行直接对比的研究更是罕见。在这一点上,伊利的行动体现了对自身产品过硬素质以及对系统模拟母乳理念的坚定信心。连续两项成功的国内婴儿临床研究结果也证实了伊利系统模拟母乳的理念走在了正确的道路上,真正扮演了开拓者的角色。
从理论研究到配方优化,再到真正应用于婴幼儿人群的临床研究,伊利在过去十八年的努力其实是整个学界对母乳模拟探索的一个缩影:
– 婴幼儿配方奶作为母乳代用品诞生之初,其主要目的是为了满足人工喂养的基本营养需求。在20世纪之初,人们认识到牛乳似乎是作为动物奶基合适的来源,但仍然需要对其进行必要的调整,以使得配方对人类婴儿来说更为安全和适口。因此人们尝试去除牛乳中的动物脂肪并用植物油进行替换,稀释蛋白质组分以适应婴儿相对不成熟的肾小管系统,同时添加矿物质、维生素等营养物质[74]使配方满足最基本的营养需求。因此,在1920-1930年间,基于牛乳的配方进入大规模生产标志着婴儿配方奶产业的正式诞生,也意味着母乳模拟跨越了第一个“配方探索时代”。
– 随着人们对婴幼儿营养需求研究的深入,如何让婴幼儿配方的营养更全面,如何更好满足婴幼儿的发育需求成为了配方奶发展的重要考量。自1930年左右开始,众多的新营养成分因为各种原因被逐步添加到配方之中[74],标志着婴幼儿配方奶粉的发展进入到了全新“营养强化的时代”。例如,1959年,铁元素被添加到配方中以减少配方奶喂养儿发生铁缺乏的风险。近年来,长链多不饱和脂肪酸也被配方奶产业利用来支持婴儿的视觉和认知发育[74]。类似的案例还包括乳清蛋白、核苷酸、SN-2棕榈酸等多种类型的营养物质,这些对配方成分一步一步的探索都是为了使得配方奶能够更加接近母乳,甚至直到今天,学界依然还在进行着这样的努力。
– 基于对母乳研究领先的经验和理解,伊利认为,单纯的成分添加并不代表真正的模拟母乳——母乳成分的精妙并非通过添加某种特定的营养成分来实现。母乳中成千上万的营养成分如何各司其职?如何相互协同?如何对婴幼儿的生长发育产生健康益处?这些问题无不要求伊利在配方研发的过程中,在技术和安全许可的范围内,尽可能全面地添加母乳中所含的营养成分,以期还原母乳成分间的内在联系和最终获益,引领中国婴幼儿营养进入系统模拟母乳的“∑时代”。
8 结语
母乳是婴儿最理想的天然食物,但母乳的组成精妙复杂,营养成分成千上万,相互联系,使得配方奶模拟母乳的进程始终极为缓慢。在这种环境下,伊利立足中国母乳研究,经过十八年的逐步积累的中国母乳研究数据,实现了在蛋白质、脂肪、核苷酸、磷脂、低聚糖和益生菌等核心营养成分方面对母乳的系统模拟,并通过基于中国婴幼儿的临床研究数据提供了系统模拟母乳理论成功的有利支持。不创新,无未来,而伊利已经站在了未来的门口,伊利真诚地希望更多的中国婴儿配方奶企业能够加入中国母乳研究的行列,与伊利携手前行,为中国宝宝的健康事业添砖加瓦,让中国的未来现在就来。
参考文献:
[1]WHO, Infant and Young Child Nutrition:Global Strategy on infant and young child feeding.2012
[2]Grote V, Verduci E, Scaglioni S, et al. Breast milk composition and infant nutrient intakes during the first 12 months of life[J]. European Journal of Clinical Nutrition,2016,70:250-256
[3]Martin R. Camilia, Ling Pei-Ra, Blackburn L. George. Review of infant feeding:key features of breast milk and infant formula[J]. Nutrients,2016,8:279
[4]荫士安. 人乳成分-存在形式,含量,功能,检测方法[D].化学工业出版社出版. 2016.
[5]Lonnerdal B, Erdmann P, Thakkar SK, et al. Longitudinal evolution of true protein, amino acids and bioactive proteins in breast milk: a developmental perspective[J]. J Nutr Biochem,2017,41(1):1-11
[6]Harris WS, Baack ML. Beyond building better brains: bridging the docosahexaenoic acid(DHA) gap of prematurity[J]. J Perinatol,2015,35(1):1-7
[7]Yu ZT, Chen C, Kling DE, et al. The principal fucosylated oligosaccharides of human milk exhibit prebiotic properties on cultured infant microbiota[J]. Glycobiology,2013,23(2):169-177
[8]Carol L. Cheatham and Kelly Will Sheppard. Synergistic effects of human milk nutrients in the support of infant recognition memory: an observational study[J]. Nutrients,2015,7:9079-9095
[9]Isaacs CE. Human milk inactivates pathogens individually, additively and synergistically[J]. J Nutr,2005,135:1286-1288
[10]Moossavi S, Miliku K, Sepehri S, et al. The prebiotic and probiotic properties of human milk: implications for infant immune development and pediatric asthma[J]. Asthma. Front. Pediatr,2018,6:197
[11]Beck KL, Weber D, Phinney BS, et al. Comparative proteomics of human and macaque milk reveals species-specific nutrition during postnatal development[J]. J Proteome Res,2015,14(5):2143-2157
[12]Jackson JG, Janszen DB, Lonnerdal B, et al. A multinational study of α-lactalbumin concentrtions in human milk[J]. J Nutr Biochem,2004,15:517–521
[13]Lonnerdal B. Nutritonal and physiologic significance of human milk proteins[J]. Am J Clin Nutr,2003,77:1537S–1543S
[14]Lonnerdal B. Bioactive proteins in human milk: health, nutrition, and implications for infant formulas[J]. The Journal of Pediatrics,2016,173S:S4-S9
[15]Kibangou IB, Bouhallab S, Henry G, et al. Milk proteins and iron absorption: contrasting effects of different caseinophosphopeptides[J]. Pediatric Research,2005,58(4):731-734
[16]Bruck WM, Redgrave M, Tuohy Kieran M, et al. Effects of bovine a-lactalbumin and casein glycomacropeptide–enriched infant formulae on faecal microbiota in healthy term infants[J]. Journal of Pediatric Gastroenterology and Nutrition,2006,43:673-679
[17]Dupont C, Rivero M, Grillon C, et al. A-Lactalbumin-enriched and probiotic-supplemented infant formula in infants with colic: growth and gastrointestinal tolerance[J]. European Journal of Clinical Nutrition,2010,64:765-767
[18]Kvistgaard AS, Pallesen LT, Arias CF, Lopez S, Petersen TE, Heegaard CW, et al. Inhibitory effects of human and bovine milk constituents on rotavirus infections. J Dairy Sci,2004,87:4088-4096
[19]Chatterton DEW, Nguyen DN, Bering SB, Sangild PT. Anti-inflammatory mechanisms of bioactive milk proteins in the intestine of newborns[J]. The International Journal of Biochemistry & Cell Biology,2013,45:1730-1747
[20]Kelleher SL, Chatterton D, Nielsen K, et al. Glycomacropeptide and lactalbumin supplementation of infant formula affects growth and nutritional status in infant rhesus monkeys[J]. Am J Clin Nutr,2003,77:1261-1268
[21]Davidson LA, Lonnerdal B. Persistence of human milk proteins in the breast-fed infant. Acta Paediatr Scand,1987,76:733-740
[22]Ashkar S, Weber GF, Panoutsakopoulou V, et al. Eta-1(osteopontin): an early component of type-1(cell-mediated)immunity. Science,2000,287:860-864
[23]Sandstrom O, Lonnerdal B, Graverholt G, Olle H. Effects of alpha-lactalbumin-enriched formula containing different concentrations of glycomacropeptide on infant nutrition[J]. Am J Clin Nutr,2008,87:921-928
[24]Elwakiel M, Boeren S, Hageman JA, et al. Variability of serum proteins in Chinese and Dutch human milk during lactation[J]. Nutrients,2019,11:499
[25]Giovannini M, Riva E, Agostoni C. FA in pediatric nutrition(Review). Pediatr. Clin. North. Am,1995,42:861
[26]Guo M. Human milk biochemistry and infant formula Manufacturing Technology. [D] Elsevier: Cambrdige, UK, 2014
[27]Much D, Brunner S, Vollhardt C, et al. Breast milk fatty acid profile in relation to infant growth and body composition: results from the INFat study[J]. Pediatric Research,2013,74(2):230-237
[28]Kumar H, Toit ED, Kulkarni A, et al. Distinct patterns in human milk microbiota and fatty acid profiles across specific geographic locations[J]. Frontiers in Microbiology,2016,7:16-19
[29]Giuffrida F,Cruzhernandez C,Bertschy E,et al. Temporal changes of human breast milk lipids of Chinese mothers[J]. Nutrients,2016, 8(11): E715.
[30]Bar-Yoseph F, Lifshitz Y, Cohen T, et al. sn2-palmitate reduces fatty acid excretion in Chinese formula-fed infants[J]. JPGN,2016,62(2):341-347
[31]Litmanovitz I, Davidson K, Eliakim A, et al. High beta-palmitate formula and bone strength in term infants: a randomized, double-blind, controlled trial[J]. Calcif Tissue Int,2013,92:35-41
[32]Yao MJ, Lien EL, Maria RZ. Capeding, et al. Effects of term infant formulas containing high sn-2 palmitate with and without oligofructose on stool composition, stool characteristics, and bifidogenicity[J]. JPGN,2014,59(4):440-448
[33]Cilla A, Diego-Quintaes K, et al. Phospholipids in human milk and infant formulas: Benefits and Needs for Correct Infant Nutrition[J]. Crit. Rev. Food Sci. Nutr,2016,56:1880-1892
[34]Verardo V, Gómez-Caravaca AM, et al. Recent advances in phospholipids from colostrum, milk and dairy by-products[J]. International Journal of Molecular Sciences,2017,18(173):1-23
[35]Holmes HC, Snodgrass GJAI, Iles RA. Changes in the choline content of human breast milk in the first 3 weeks after birth[J]. Eur J Pediatr,2000,159:198-204
[36]Liu H, Radlowski EC, et al. Early Supplementation of phospholipids and gangliosides affects brain and cognitive development in neonatal piglets[J]. The Journal of Nutrition,2014,144:1903-1909
[37]Babenko NA and Shakhova EG. Effects of calorie-restricted diet on the content of phospholipids in the brain and cognitive functions in rats[J]. Neurophysiology,1979,44:201-217
[38]Singh H. The milk fat globule membrane-a biophysical system for food applications[J]. Curr Opin Colloid Interface Sci,2006,11(2-3):154-163
[39]Timby N, Domellof E, Hernell O, et al. Neurodevelopment, nutrition, and growth until 12 mo of age in infants fed a low-energy, low-protein formula supplemented with bovine milk fat globule membranes: a supplemented with bovine milk fat globule membranes:a randomized controlled trial[J]. Am J Clin Nutr,99(4):860-868
[40]Timby N, Hernell O, Vaarala O, et al. Infections in infants fed formula supplemented withbovine milk fat globule membranes[J]. J Pediatr Gastroenterol Nutr,2015,60(3):384-389
[41]Timby N, Lonnerdal B, Hernello, et al. Cardiovascular risk markers until 12 mo of age in infants fed a formula supplemented with bovine milk fat globule membranes[J]. Pediatr Res,2014,76(4):394-400
[42]Deng L, Zou Q, Liu B, et al. Fatty acid positional distribution in colostrum and mature milk of women living in Inner Mongolia, North Jiangsu and Guangxi of China[J]. Food Func,2018,9(8):4234-4245
[43]Yang M, Cong M, Peng X, et al. Quantitative proteomic analysis of milk fat globule membrane (MFGM) proteins in human and bovine colostrum and mature milk samples through iTRAQ labeling[J]. Food Funct,2016,7(5):2438-2450
[44]施茜, 叶侃, 古桂雄. 母乳的成分及有关影响因素[J]. 中国妇幼健康研究,2018,29(10):1269-1273
[45]Chang N, Jung JA, Kim H, et al. Macronutrient composition of human milk from Korean mothers of full term infants born at 37-42 gestational weeks[J]. Nutr Res Pract,2015,9(4):433-438
[46]Liu JC, Dong XY, Liu TM, et al. Analysis between correlation factors of neonate and the content of macro nutrients in breast milk[J]. Science and technology of food industry, 2016, 21:353-362
[47]Gidrewicz Dominica A and Fenton Tanis R. A systematic review and meta-analysis of the nutrient content of preterm and term breast milk[J]. BMC Pediatrics,2014,14:216-230
[48]Prentice P, Ong KK, Schoemaker Marieke H, et al. Breast Milk Nutrient Content and Infancy Growth [J]. Acta Pædiatrica,2016,105:641-647
[49]Gray BM, Egan M L, Pritchard D G. Specificity of monoclonal antibodies against group B streptococcus type 2 and inhibition of their binding by human secretions[J]. Pediatr Res,2013,24(1):68-72
[50]Walker WA, Iyengar RS. Breast milk, microbiota and intestinal immune homeostasis[J]. Pediatr Res,2015,77(1-2):220-228
[51]Thompson JM, Wall C, Becroft DM, et al. Maternal dietary patterns in prenancy and the association with small-for-gestational-age infants[J]. Br J Nutr,2010,103(11):1665-1673
[52]Wang B, Brand-Miller J. The role and potential of sialic acid in human nutrition[J]. Eur J Clin Nutr,2003,57(11):1351-1369
[53]Gurnida DA., Rowan AM, Idjradinata P, et al. Association of complex lipids containing gangliosides with cognitive development of 6-month-old infants[J]. Early Human Development,2012,88:595-601
[54]Li HY, Gao WW, Shao ZL, et al. Effect of maternal sialic acid on intelligence development of normal term infants[J]. Maternal and Child Health Care of China, 2013,28:1616-1618
[55]Moheb E , Jos H , Wendan W , et al. Human milk oligosaccharides in colostrum and mature milk of Chinese mothers: Lewis positive secretor subgroups[J]. J. Agric. Food Chem.2018, 66, 7036−7043.
[56]Sakwinska O, Moine D, Delley M, et al. Microbiota in breast milk of Chinese lactating mothers[J]. PLOS one,2016:1-14
[57]Singhal A, Kennedy K, Lanigan J, et al. Dietary nucleotides and early growth in formula-fed infants: a randomized controlled trial[J].Pediatrics,2010,126:946
[58]Singhal A, Macfarlane G, Macfarlane S, et al. Dietary nucleotides and fecal microbiota in formula-fed infants: a randomized controlled trial[J]. Am J Clin Nutr,2008,87:1785-1792
[59]Barness LA. Dietary sources of nucleofides from bresat milk to weaning[J]. J Nutr,1994,124(1):128-130
[60]Yau KT, Huang CB, Chen W, et al. Effect of nucleotides on diarrhea and immune responses in healthy term infants in Taiwan[J]. Pediatr Gastro-enterol Nutr, 2003,36:37-43
[61]Gutie’rrez-Castrellon P. Immune response to nucleotide-supplemented infant formulae: systematic .British review and meta-analysis[J].Journal of Nutrition,2007, 98(Suppl.1):S64-S67
[62]Tressler RL, Ramstack MB, White NR, et al. Determination of total potentially available nucleosides in human milk from Asian women. Nutrition 2003;19:16-20
[63]Leach JL, Baxter JH, Molitor BE, et al. Total potentially available nucleosides of human milk by stage of lactation. Am J Clin Nutr,1995,61:1224-1230
[64]Liao KY, Wu TC, Huang CF, et al. Profile of nucleotides and nucleosides in Taiwanese human milk[J]. Pediatrics and Neonatology,2011,52:93-97
[65]Witkowska-Zimny M and Kaminska-El-Hassan E. Cells of human breast milk[J]. Cellular & Molecular Biology Letters,2017,22:11
[66]Sharpe J, Way M, Koorts PJ, Davies MW. The availability of probiotics and donor human milk is associated with improved survival in very preterm infants[J]. World Journal of Pediatrics,2018
[67]Mao M, Yu T, Xiong Y, et al. Effect of a lactose-free milk formula supplemented with bifidobacteria and streptococci on the recovery from acute diarrhea[J]. Asia Pac J Clin Nutr,2008,17:30-34
[68]Samuli R, Heikki A, Erika I. Specific probiotics in enhancing maturation of IgA responses in formula-fed infants[J]. Pediatric Research,2006,60(2):222-225
[69]Ahmed M, Prasad J, Gill H, et al. Impact of consumption of different levels of Bifidobacterium lactis HN019 on the intestinal microflora of elderly human subjects[J]. J Nutr Health Aging,2007,11(1):26-31.
[70]Ibarra A, Latreille-Barbier M, Donazzolo Y, et al. Effects of 28-day Bifidobacterium animalis subsp. lactis HN019 supplementation on colonic transit time and gastrointestinal symptoms in adults with functional constipation: a double-blind, randomized, placebo-controlled, and dose-ranging trial[J]. Gut Microbes,2018,9(3): 236-251.
[71]Weizman Z, Asli G, Aisheikh A, et al. Effect of a probiotic infant formula on infections in child care centers: comparison of two probiotic agents[J]. Pediatrics 2005,115(1):5-9
[72]Zhou JS,Gopal PK, GillI H S. Potential probiotic lactic acid bacteria lactobacillus rhamnosus(HN001), lactobacillus acidophilus(HN017) and bifidobacterium lactis(HN019) do not degrade gastric mucin in vitro[J]. Int J Food Microbiol,2001,63(1-2):81-90
[73]Bruzzese E, Volpicelli M, Squeglia V, et al. A formula containing galacto- and fructo-oligosaccharides prevents intestinal and extra-intestinal infections: an observational study[J]. Clin Nutr,2009,28:156-161
[74]Committee on the Evaluation of the Addition of Ingredients New to Infant Formula. Infant Formula: Evaluating the Safety of New Ingredients. ISBN: 0-309-53022-9, 2004